Farmakologiczne właściwości polisiarczanu mukopolisacharydu
Wprowadzenie
Polisiarczan mukopolisacharydu (MPS) jest półsyntetyczną mieszaninę glikozaminoglikanów otrzymywaną z chrząstki zwierząt, a następnie poddawaną procesowi siarczanowania. Średnia masa cząsteczkowa wynosi 9700 g/mol. Strukturalnie MPS stanowi nierozgałęziony polimer składający się z reszt kwasu glukuronowego oraz N-acetygalaktozaminy. Właściwości MPS są determinowane stopniem usiarczanowienia reszt cukrowych [1].
MPS - wskazania
Polisiarczan mukopolisacharydu stosowany bezpośrednio na skórę działa długotrwale i łagodzi ból i uczucie napięcia oraz skraca czas rekonwalescencji u osób z krwiakami, stłuczeniami, obrzękami, naderwanymi ścięgnami/więzadłami, jak i z zapaleniem żył powierzchownych. Korzystnie także działa u osób z żylakami kończyn dolnych, w zmiękczaniu blizn czy też w jonoforezie. Jego kliniczną przydatność potwierdzono w wytycznych, jak i w badaniach klinicznych[2,3]
Właściwości MPS
MPS cechuje się właściwościami przeciwkrzepliwymi, przeciwzakrzepowymi oraz fibrynolitycznymi [4]. Niemniej jednak dodatkowo uwalnia inhibitor czynnika tkankowego (ang. tissue factor pathway inhibitor, TFPI) oraz zwiększa stężenie aktywatora plazminogenu, co skraca czas potrzebny na eliminację złogów włóknika z tkanek objętych procesem zapalnym. Ponadto MPS wpływając na płytki krwi hamuje tworzenie się skrzepu, co ułatwia reperfuzję [5, 6]. W badaniach na zwierzętach, jak i na ludziach wykazano, że MPS przenika przez skórę, nie mniej jednak u człowieka stopień absorpcji do układu krążenia jest zbyt niski, aby MPS stosowany w postaci kremu mógł wpłynąć na parametry krzepliwości krwi. MPS zatrzymywany jest w tkance podskórnej, powięziach, ścięgnach oraz mięśniach [7].
Przeciwzapalne właściwości MPS
W badaniach zaobserwowano, że MPS poza właściwościami przeciwzakrzepowymi i fibrynolitycznymi posiada także właściwości przeciwzapalne. Hamuje enzymy proteolityczne uwalniane przez lizosomy z uszkodzonych tkanek (elastaza, katepsyna, glukuronidaza, galaktozydaza) w katabolicznej fazie zapalenia, jak również zmniejsza aktywność układu dopełniacza, leukotrienu LTB4 czy też prostaglandyny PGE2 [8].
Jak już wcześniej wspomniano MPS zdolny jest do aktywacji TFPI po aplikacji na skórę (jako krem). TFPI jest najsilniejszym naturalnym inhibitorem zewnątrzpochodnego układu krzepnięcia i produkowany jest przez śródbłonek. Jego masa cząsteczkowa wynosi 42 kD i będąc białkiem składa się z trzech domen. Pierwsza z nich łączy się z kompleksem czynnika tkankowego z czynnikiem VII, w drugiej wiąże się aktywny czynnik Xa, a trzecia odpowiada za wiązanie się TFPI z heparyną i lipoproteinami. Większość TFPI wiąże się z głównym miejscem jego produkcji, czyli śródbłonkiem, natomiast 90% krążącego TFPI pozostaje w ścisłym związku z lipoproteinami, głównie z cholesterolem frakcji LDL. Inhibitor ten wykazuje dwustopniowe działanie hamujące kaskadę krzepnięcia. W pierwszej fazie łączy się z aktywnym czynnikiem X, a następnie w kompleksie z nim wiąże kompleks czynnika tkankowego z aktywnym czynnikiem VII, blokując jego aktywność enzymatyczną. TFPI hamuje wpływ czynnika tkankowego, który uwalniany jest podczas procesu zapalnego i który oddziałuje jak mediator stanu zapalnego. Tym samym przypuszcza się, że zdolność zastosowanego miejscowo MPS do aktywacji TFPI jest jednym z mechanizmów odpowiedzialnych za przeciwzapalne właściwości tego leku [9].
Mathias i wsp. badali wpływ MPS na zwiększenie przepuszczalności tkanek spowodowanej aktywacją hialuronidazy [10]. W teście dystrybucji barwnika w modelu zwierzęcym wykazano istotnie statystycznie większe zahamowanie aktywności hialuronidazy przez MPS w porównaniu z placebo, co innymi słowy oznaczało zahamowanie szerzenia się procesu zapalnego (Rycinia 1).
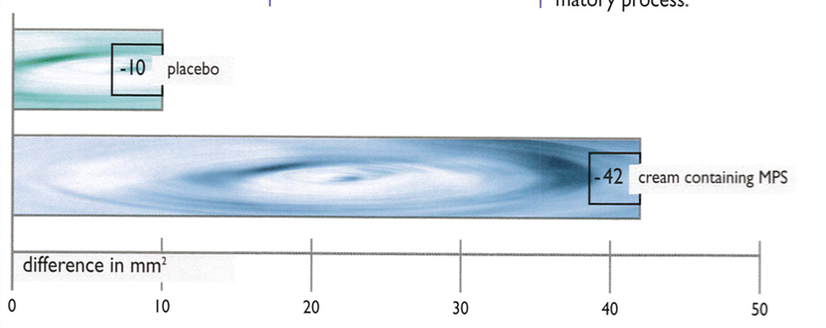
Rycina 1. Zahamowanie hialuronidazy w teście dystrybucji barwnika po zastosowaniu placebo lub kremu zawierającego MPS.
Z kolei Egg i wsp. wykazali zahamowanie syntezy prostaglandyn przez MPS. Szczególnie istotne jest zahamowanie syntezy prostaglandyny E2, jako tej która odgrywa istotną rolę w rozwoju procesu zapalnego i powstawania bólu [11]. W innych badaniach wykazano także, że MPS w stężeniach terapeutycznych skutecznie blokuje powstawanie mediatorów stanu zapalnego poprzez zahamowanie aktywacji układu dopełniacza oraz uwalnianie leukotrienu B4. Wyraźne zahamowanie składowej C1q dopełniacza obserwuje się już przy bardzo niskich stężeniach zastosowanego MPS [12].
Natomiast Hoppensteadt i wsp. badali zdolność miejscowo zastosowanego MPS do uwolnienia TFPI [13]. Jak już wcześniej wspomniano TFPI poprzez wiązanie czynnika tkankowego jest wstanie ograniczyć toczący się proces zapalny. W 10-dniowym eksperymencie na małpach stosowano 3% krem zawierający MPS lub placebo 1., 2., 5., 7. oraz 10. dnia badania. Próbki krwi pobierano wyjściowo, a także po 2., 4., 8. oraz 24. godzinach od zastosowania MPS. Analizowano liczbę płytek krwi, APTT, czas trombinowy oraz stężenia całkowitego, jak i wolnego TFPI. W przeciwieństwie do grupy placebo w grupie otrzymującej MPS obserwowano progresywnie wzrastające stężenia zarówno wolnego, jak i całkowitego TFPI. W grupie placebo nie stwierdzono jakiegokolwiek wzrostu stężenia TFPI. Różnice w stężeniu TFPI pomiędzy grupami stały się istotne statystycznie 7. oraz 10. dnia obserwacji (p < 0,05). Parametry krzepnięcia pozostały na niezmienionym poziomie przez cały okres eksperymentu. Wyniki tego badania doprowadziły do wniosku, że po aplikacji na skórę MPS osiąga kapilarne łożysko naczyniowe, w którym substancja działa przeciwzapalnie i przeciwkrzepliwie, jednakże pozostaje bez wpływu na systemowe parametry krzepnięcia (Rycina 2).
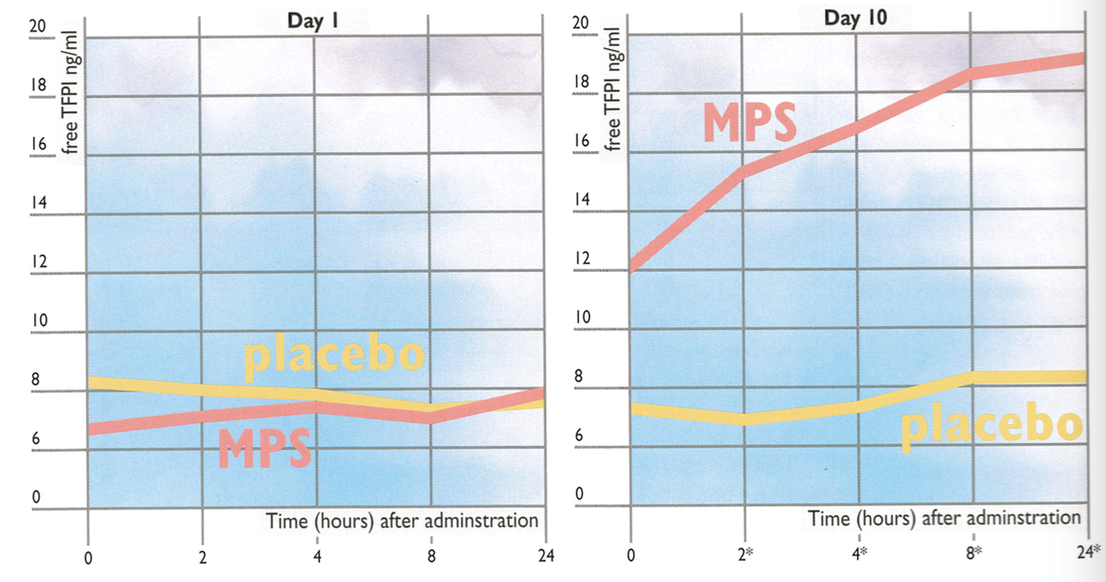
Rycina 2. Stężenie wolnego TFPI przed i po aplikacji na skórę MPS lub placebo.
Warto na zakończenie wspomnieć jeszcze o jednym praktycznym aspekcie działania MPS. Oparzenia słoneczne są swoistym stanem zapalnym powierzchownych warstw skóry. Ponieważ przeciwzapalny potencjał MPS jest dobrze udokumentowany, analiza skuteczności MPS w postaci kremu w tym wskazaniu budzi żywe zainteresowanie. Rumień indukowany UV jest modelem stanu zapalnego, w którym zahamowanie zaczerwienienia skóry przez środki farmaceutyczne oceniane jest jako miernik właściwości przeciwzapalnych.
Raake i wsp. zbadali potencjał przeciwzapalnych właściwości kremu zawierającego MPS na wielkość rumienia indukowanego UV w modelu świnek morskich [14]. Stopień nasilenia rumienia wyrażano w wartościach od 0 do 4,0 (metoda Ther). Bezpośrednio po zakończeniu napromieniania krem zawierający MPS lub heparynę były delikatnie wmasowywane w leczone powierzchnie. W grupie kontrolnej stopień nasilenia rumienia wynosił 2,5 – 3,0. Wszystkie badane preparaty zahamowały powstawanie rumienia UV, jednakże były duże rozbieżności pomiędzy stopniem zahamowania. Najskuteczniejszym produktem był MPS z odsetkiem zahamowania wynoszącym 60%. Wpływy maści z heparyną bardzo się różniły, co przedstawiono na Rycinie 3.
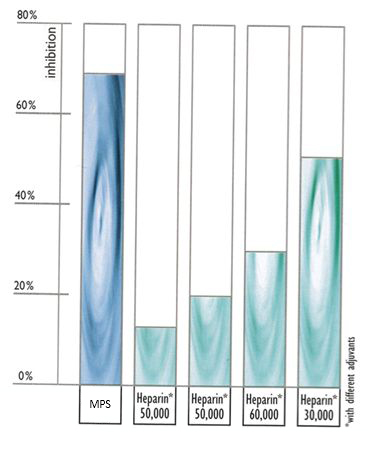
Rycina 3.Zahamowanie rozwoju rumienia po miejscowym zastosowaniu MPS.
Podsumowanie:
Polisiarczan mukopolisacharydu stosowany w kremie jest podobny do naturalnych mukopolisacharydów występujących w organizmie. Właściwości farmakologiczne, w tym przeciwzapalne, MPS stosowanego miejscowo dobrze korelują z potwierdzonymi efektami klinicznymi.
Opracował:
dr n. med. Jacek Bil
Centralny Szpital Kliniczny MSW
ul. Wołoska 137, Warszawa
Piśmiennictwo:
- Lane, D.A., et al., Comparison of heparin and a semi-synthetic heparin analogue, A73025. I. Kinetics of clearance from the circulation of man following intravenous injection. Br J Haematol, 1977. 37(2): p. 239-45.
- Vecchio, C. and A. Frisinghelli, Topically applied heparins for the treatment of vascular disorders : a comprehensive review. Clin Drug Investig, 2008. 28(10): p. 603-14.
- Cesarone, M.R., et al., Management of superficial vein thrombosis and thrombophlebitis: status and expert opinion document. Angiology, 2007. 58 Suppl 1: p. 7S-14S; discussion 14S-15S.
- Gorog, P. and W. Raake, Antithrombotic effect of a mucopolysaccharide polysulfate after systemic, topical and percutaneous application. Arzneimittelforschung, 1987. 37(3): p. 342-5.
- Klocking, H.P. and W. Raake, Enhancement of t-PA release by mucopolysaccharide polysulphate. Thromb Res, 1992. 66(1): p. 89-92.
- Hoppensteadt, D.A., et al., Endogenous release of tissue factor pathway inhibitor by topical application of an ointment containing mucopolysaccharide polysulfate to nonhuman primates. Thromb Res, 2001. 103(2): p. 157-63.
- Elling, H., Penetration of mucopolysaccharides into the skin of diverse animal species. Arzneimittelforschung, 1986. 36(10): p. 1525-7.
- Sorrentino, L. and M. Di Rosa, [The inflammation-inhibiting effect of adrenal cortex hormones, mucopolysaccharidepolysulfuric acid ester and salicylic acid after percutaneous administration]. Arzneimittelforschung, 1966. 16(7): p. 855-8.
- Radziwon, P., et al., Inhibitor zależnej od czynnika tkankowego drogi krzepnięcia (TFPI) u chorych na zarostowe choroby naczyń tętniczych z uwzględnieniem czynników ryzyka i leczenia zachowawczego. Acta Angiol., 2001. 7(1-2): p. 43-54.
- Mathies, H. and W. Gabler, Animal tests to demonstrate the percutaneous efficacies of an adrenal extract, a heparin body and of salicylic acid in ointment form. Med Klin, 1963(58): p. 18.
- Egg, D., Effects of glycosaminoglycan-polysulfate and two non-steroidal anti-inflammatory drugs on prostaglandin E2 synthesis in chinese hamster ovary cell cultures. Pharmacol Res Commun, 1983. 15(8): p. 709-717.
- Heinz, H. and M. Loos, Wirkung eines Mucopolysaccharidpolyschwefelsaureesters auf das Komplementsystem. Z Rheumatol, 1982. 41(4): p. 140.
- Hoppensteadt, D., et al., Engogenous release of tissue factor pathway inhibitor by topical application of an ointment containing mucopolysaccharide polysulfate to nonhuman primates. Thrombosis Research, 2001. 103: p. 157-163.
- Raake, W., Vergleich der antiphlogistischen Wirkung von Mucopolysaccharidpolyschwefelsaureester-Salben mit heparin-haltigen Salben im UV-Erythem Test. Drug Res, 1984. 34(4): p. 449-451.
Artykuły
studium przypadku
Zakrzepowe zapalenie żył powierzchownych u 46-letniej kobiety
Zakrzepowe zapalenie żył powierzchownych jest to zapalenie żył umiejscowionych nad powięzią, któremu najczęściej towarzyszy proces zakrzepowy o różnym stopniu nasileniu. W 90 proc. przypadków zapalenie żył powierzchownych dotyczy żylaków, częściej żyły odpiszczelowej, a znacznie rzadziej żyły odstrzałkowej.
Pobranie krwi – mały duży problem!
Przypadek 33-letniego mężczyzny, który udał się na pobranie krwi przy okazji okresowej wizyty u lekarza medycyny pracy. W trakcie pobrania krwi z żyły odłokciowej doszło jednak do jej przekłucia i uszkodzenia wskutek czego powstał znacznego rozmiaru krwiak na przedramieniu.

Krwiak pourazowy u 27-letniego mężczyzny
Przypadek 27-letniego mężczyzny, który zgłosił się na SOR z powodu urazu i silnego bólu podudzia lewego przy najmniejszym ruchu. Uraz powstał w trakcie gry w piłkę nożną wskutek zderzenia z zawodnikiem przeciwnej drużyny